Выявление β-лактамаз расширенного спектра у грамотрицательных бактерий с помощью фенотипических методов
Клиническая Микробиология и Антимикробная Химиотерапия. 2001; 3(2):183-189
Аннотация
Продукция β-лактамаз расширенного спектра (БЛРС) – один из наиболее распространенных и клинически значимых механизмов резистентности энтеробактерий к современным β-лактамным антибиотикам. Однако эффективность выявления устойчивости, связанной с продукцией БЛРС, с помощью традиционных методов оценки чувствительности остается крайне низкой. В связи с этим ниже представлены рекомендации по использованию специальных фенотипических методов выявления БЛРС, описаны их преимущества и ограничения. Для врачей-микробиологов, эпидемиологов, лаборантов.
1. Введение
Что такое b-лактамазы расширенного спектра?
Термин "b-лактамазы расширенного спектра" (от англ. extended-spectrum b-lactamases – ESBL) объединяет большое число бактериальных ферментов, которые отличаются способностью расщеплять оксиимино-b-лактамы (цефалоспорины III–IV поколений и азтреонам) наряду с пенициллинами и ранними цефалоспоринами и проявляют чувствительность к ингибиторам (клавулановой кислоте, сульбактаму и тазобактаму).
Большинство БЛРС являются производными широко распространенных плазмидно кодируемых пенициллиназ TEM-1, TEM-2 и SHV-1 и отличаются от них единичными аминокислотными заменами, расширяющими спектр ферментативной активности. Согласно классификации K. Bush, G. Jacoby и A. Medeiros, ферменты этого типа относятся к функциональной группе 2be.
Характерную для БЛРС активность могут проявлять и некоторые другие плазмидные b-лактамазы, например ферменты CTX-M- и OXA-типа (последние в меньшей степени подавляются клавулановой кислотой), а также видоспецифические хромосомные b-лактамазы Klebsiella oxytoca, Proteus vulgaris и Citrobacter diversus. Вопрос о возможности включения видоспецифических b-лактамаз в группу БЛРС пока остается спорным.
Распространенность БЛРС
БЛРС, впервые обнаруженные в Англии, Германии и Франции в середине 80-х годов, в настоящее время широко распространены в большинстве стран мира. Наиболее частыми продуцентами БЛРС являются нозокомиальные штаммы Klebsiella spp., в меньшей степени – Escherichia coli и Proteus mirabilis. Реже продукция БЛРС отмечается у других представителей семейства Enterobacteriaceae, а также у некоторых неферментирующих грамотрицательных палочек, включая Pseudomonas aeruginosa.
Встречаемость БЛРС у нозокомиальных штаммов Klebsiella pneumoniae составляет в различных странах от 7 до 75%. В отдельных стационарах лечебно-профилактических учреждений России частота выявления этих ферментов у клебсиелл достигает 90%.
Почему необходимо выявлять продукцию БЛРС?
Данные многочисленных исследований показывают, что продукция БЛРС приводит к формированию устойчивости ко всем пенициллинам, цефалоспоринам и монобактамам и часто является причиной их клинической неэффективности. Вместе с тем стандартные методы определения чувствительности не всегда позволяют выявить истинную резистентность БЛРС-продуцирующих штаммов, поскольку такие штаммы могут проявлять in vitro уровень устойчивости к современным цефалоспоринам ниже установленных пограничных значений (чувствительность – умеренная резистентность).
Своевременная и регулярная диагностика БЛРС способствует таким образом проведению рациональной и эффективной антибиотикотерапии.
Какие штаммы нужно тестировать на наличие БЛРС?
В настоящее время не существует общепринятых рекомендаций относительно выбора штаммов, которые необходимо тестировать на наличие БЛРС. Однако, учитывая распространенность ферментов этой группы, представляется целесообразным использовать специальные методы их диагностики у следующих микроорганизмов:
- всех нозокомиальных штаммов Klebsiella spp. и E.coli;
- любых штаммов энтеробактерий, которые по данным предварительного тестирования проявляют пониженную чувствительность (МПК>1 мг/л) к одному из цефалоспоринов III поколения.
2. Методы выявления БЛРС
Различные фенотипические методы, применяемые в настоящее время для обнаружения продукции БЛРС, основаны на эффекте подавления их активности в отношении оксиимино-b-лактамов в присутствии клавулановой кислоты. Выбор конкретного метода определяется целями и возможностями лаборатории.
2.1. Метод "двойных дисков"
Принцип
Метод "двойных дисков" представляет собой вариант классического дискодиффузионного метода определения чувствительности, который позволяет обнаружить продукцию БЛРС по наличию расширенной зоны подавления роста вокруг диска с цефалоспорином III поколения напротив диска, содержащего клавулановую кислоту (синергизм отмечается в участке пересечения зон диффузии двух дисков, расположенных на небольшом расстоянии друг от друга).
Материалы
1. Стерильный физиологический раствор.
2. Стерильные пробирки, пипетки, чашки Петри.
3. Стандарт мутности 0,5 по МакФарланду (эквивалент ≈1,5 x 108 КОЕ/мл).
4. Агар Мюллера–Хинтона.
5. Диски с антибиотиками: азтреонам (30 мкг), цефотаксим (30 мкг), цефтазидим (30 мкг), цефтриаксон (30 мкг), цефепим (30 мкг), цефпиром (30 мкг), амоксициллин/клавуланат (20/10 мкг).
6. Термостат.
7. Контрольные штаммы:
- E.coli ATCC® 25922 – отрицательный контроль (БЛРС–);
- K.pneumoniae ATCC® 700603 – положительный контроль (БЛРС+).
8. Суточные культуры исследуемых микроорганизмов.
Постановка теста
Для приготовления инокулюма используют чистую суточную культуру исследуемого микроорганизма, выращенную на агаризованной среде. Несколько колоний стерильным тампоном или петлей переносят в пробирку с 3 мл стерильного физиологического раствора. Взвесь бактериальных клеток доводят до мутности 0,5 по МакФарланду и наносят стерильным ватным тампоном на поверхность агара Мюллера–Хинтона в трех различных направлениях.
Через 5–10 мин после инокулирования на подсохшую поверхность агара накладывают диски с антибиотиками: в центр – диск, содержащий клавулановую кислоту, обычно в виде комбинации амоксициллин/клавуланат (20/10 мкг), по бокам от него на расстоянии 20 и 30 мм между центрами дисков – диски с цефтазидимом (30 мкг) и цефотаксимом (30 мкг).
Использование двух дисков каждого антибиотика, расположенных на разном расстоянии от диска с клавулановой кислотой, позволяет повысить эффективность обнаружения БЛРС (рис. 1).
Чашки инкубируют в термостате при температуре 35oС в течение 18–20 ч.
Параллельно с анализом испытуемых культур исследуют контрольные штаммы.
 |
 |
 |
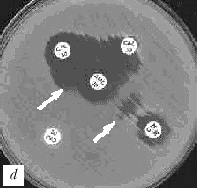 |
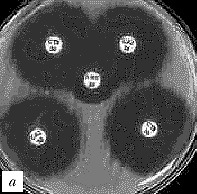
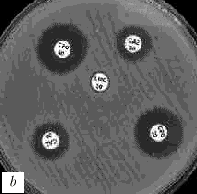
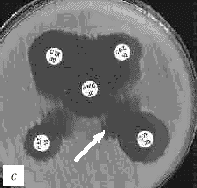
Рис. 1. Выявление продукции БЛРС с помощью метода "двойных дисков".
Отрицательные результаты (БЛРС-): a - E.coli (TEM-1), b - E.cloacae (гиперпродукция AmpC).
Положительные результаты (БЛРС+): c - K.pneumoniae (SHV-2); d - K.pneumoniae (SHV-5).
Обозначения дисков: AMC -
амоксициллин/клавулановая кислота (20/10 мкг), CAZ - цефтазидим (30 мкг), CTX - цефотаксим (30 мкг), CPO - цефпиром (30 мкг)
Учет и интерпретация результатов
Расширение зоны подавления роста между одним или несколькими дисками с оксиимино-b-лактамами и диском, содержащим клавулановую кислоту, указывает на наличие БЛРС (рис. 1, c и d).
Независимо от абсолютных значений диаметров зон подавления роста штаммы, продуцирующие БЛРС, рассматриваются как устойчивые ко всем пенициллинам, цефалоспоринам (за исключением цефамицинов) и монобактамам.
Примечание
1. Использование дисков с разными оксиимино-b-лактамами позволяет повысить чувствительность обнаружения БЛРС, поскольку ферменты этой группы могут проявлять различную субстратную специфичность. Помимо рекомендуемых дисков с цефтазидимом и цефотаксимом в исследование могут быть включены диски с цефподоксимом, цефтриаксоном, цефепимом, цефпиромом, азтреонамом.
2. Для выявления БЛРС у штаммов Enterobacter spp., Citrobacter freundii, Serratia spp., Morganella morganii, Providencia stuartii, P. rettgeri предпочтительно использовать диски с цефалоспоринами IV поколения (цефепимом и/или цефпиромом), которые в меньшей степени расщепляются хромосомными цефалоспориназами этих видов бактерий.
3. У штаммов K. oxytoca положительный результат тестирования с дисками, содержащими цефотаксим, цефтриаксон и азтреонам, может быть вызван гиперпродукцией хромосомных b-лактамаз (K1, OXY). Для дифференциации плазмидных БЛРС у K. oxytoca рекомендуется использовать диски с цефтазидимом.
4. При использовании дисков с цефотаксимом и цефтриаксоном для тестирования Proteus vulgaris, P. penneri и Citrobacter diversus возможен ложноположительный результат вследствие гиперпродукции хромосомных b-лактамаз. Для выявления плазмидных БЛРС у этих видов рекомендуется использовать диски с цефтазидимом и азтреонамом.
5. При наличии предварительных данных о чувствительности исследуемых штаммов расстояние между дисками может быть изменено для облегчения обнаружения БЛРС. Например, при тестировании высокорезистентных штаммов E. cloacae расстояние между дисками с цефалоспоринами и клавулановой кислотой может быть сокращено до 15 мм, а при анализе "чувствительных" штаммов P. mirabilis увеличено до 35 мм.
6. Благодаря возможности использования разных субстратов метод "двойных дисков" является наиболее чувствительным. Однако его недостатком является субъективность интерпретации результатов.
2.2. Метод E-тестов
Принцип
Е-тесты, выпускаемые компанией AB BIODISK (Швеция), представляют собой пластиковые полоски, на внутренней (обращенной к агару) стороне которых нанесен антибиотик в заданном градиенте концентрации, а на внешней стороне – шкала соответствующих значений МПК.
Е-тесты, используемые для выявления БЛРС, содержат на противоположных концах полоски два убывающих по направлению к центру градиента концентрации: цефтазидима (диапазон МПК – 0,5–32 мг/л) и комбинации цефтазидима (диапазон МПК – 0,125–8 мг/л) с клавулановой кислотой, нанесенной в фиксированной концентрации (4 мг/л) вдоль градиента (рис. 2).
Определение продукции БЛРС с помощью Е-тестов основано на количественном сравнении МПК цефтазидима и цефтазидима/клавулановой кислоты.
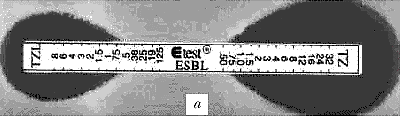 |
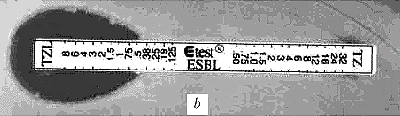 |
Рис. 2. Выявление продукции БЛРС с помощью E-тестов: a - E.coli (TEM-1), отрицательный результат - МПКTZ=МПКTZL=1, МПКTZ/МПКTZL <8; b - E.coli (TEM-3), положительный результат - МПКTZ=32, МПКTZL=0,5, МПКTZ/МПКTZL = 64
Материалы
1. Стерильный физиологический раствор.
2. Стерильные пробирки, пипетки, чашки Петри.
3. Стандарт мутности 0,5 по МакФарланду.
4. Агар Мюллера–Хинтона.
5. Комбинированные полоски Е–тестов – TZ/TZL (кат. № 5100–2820, 5100–2828).
6. Термостат.
7. Контрольные штаммы:
- E.coli ATCC® 25922 – отрицательный контроль (БЛРС–);
- K.pneumoniae ATCC® 700603 – положительный контроль (БЛРС+).
8. Суточные культуры исследуемых микроорганизмов.
Постановка теста
Приготовление суспензии бактериальных клеток и инокулирование чашек с агаром проводят в соответствии с методикой, описанной в разделе 2.1. На поверхность агара накладывают полоски E-тестов. Чашки инкубируют в термостате при температуре 35oС в течение 18–20 ч. Значения МПК считывают по шкале цифровых значений в участке ее пересечения контуром зоны подавления роста.
Интерпретация результатов
Соотношение МПК цефтазидима (TZ) и цефтазидима/клавулановой кислоты (TZL) боль-шее либо равное 8 (МПКTZ/ МПКTZL >8) указывает на наличие БЛРС.
Примечание
Отдельные b-лактамазы расширенного спектра, проявляющие невысокую активность в отношении цефтазидима, не могут быть обнаружены с помощью данного метода. Соотношение МПКTZ/МПКTZL для штаммов, продуцирующих такие ферменты, может быть меньше 8.
2.3. Тест OXOID
Принцип
Метод основан на количественном сравнении диаметров зон подавления роста вокруг дисков, содержащих цефподоксим и комбинацию цефподоксима с клавулановой кислотой.
Материалы
1. Стерильный физиологический раствор.
2. Стерильные пробирки, пипетки, чашки Петри.
3. Стандарт мутности 0,5 по МакФарланду.
4. Агар Мюллера–Хинтона.
5. Диски с цефподоксимом (CPD – 10 мкг) и цефподоксимом/клавулановой кислотой (CD01 – 10/1 мкг).
6. Термостат.
7. Контрольные штаммы:
- E.coli ATCC® 25922 – отрицательный контроль (БЛРС–),
- K.pneumoniae ATCC® 700603 – положительный контроль (БЛРС+).
8. Суточные культуры исследуемых микроорганизмов.
Постановка теста
Приготовление суспензии бактериальных клеток и инокулирование чашек с агаром проводят в соответствии с методикой, описанной в разделе 2.1. На поверхность агара накладывают диски с цефподоксимом и цефподоксимом/клавулановой кислотой. Чашки инкубируют в термостате при температуре 35oС в течение 18–20 ч.
Интерпретация результатов
Различие в диаметрах зон подавления роста для дисков с цефподоксимом/клавулановой кислотой и цефподоксимом на 6 мм и более (CD01 – CPD >6 мм) свидетельствует о наличии БЛРС.
Примечание
Данный метод является высокочувствительным и экономичным, однако допускает возможность получения ложноположительных результатов.
2.2. Метод, рекомендуемый Национальным комитетом по клиническим лабораторным стандартам США (NCCLS)
Принцип
Процедура выявления БЛРС у штаммов E.coli, K.pneumoniae и K. oxytoca, рекомендуемая NCCLS, включает два последовательных этапа:
1) скрининг БЛРС на основании определения чувствительности с помощью дискодиффузионного метода или роста в бульоне, содержащем оксиимино-b-лактамы;
2) подтверждающий тест с использованием комбинаций оксиимино-b-лактамов с клавулановой кислотой.
Материалы
1. Стерильный физиологический раствор.
2. Стерильные пробирки, пипетки, чашки Петри.
3. Стандарт мутности 0,5 по МакФарланду.
4. Термостат.
5. Контрольные штаммы:
- E.coli ATCC® 25922 – отрицательный контроль (БЛРС–);
- K.pneumoniae ATCC® 700603 – положительный контроль (БЛРС+).
6. Суточные культуры исследуемых микроорганизмов.
7. Для дискодиффузионного метода:
- агар Мюллера–Хинтона;
- диски с антибиотиками – азтреонам (30 мкг), цефотаксим (30 мкг), цефподоксим (10 мкг), цефтазидим (30 мкг), цефтриаксон (30 мкг), цефтазидим/клавуланат (30/10 мкг), цефотаксим/клавуланат (30/10 мкг).
8. Для метода разведений в бульоне:
- бульон Мюллера–Хинтона со стандартизированным содержанием катионов;
- субстанции антибиотиков с известной активностью – азтреонам, цефотаксим, цефподоксим, цефтазидим, цефтриаксон, клавулановая кислота.
Постановка теста
Поскольку БЛРС-продуцирующие штаммы могут проявлять in vitro уровень устойчивости к цефалоспоринам III поколения и монобактамам ниже установленных пограничных значений (чувствительность – умеренная резистентность), в 1999 г. NCCLS были предложены менее строгие критерии выявления штаммов, предположительно экспрессирующих БЛРС (табл. 1).
Таблица 1. Сравнение стандартных пограничных значений и критериев выявления продукции БЛРС на основании оценки МПК и диаметров зон подавления роста *
| ||||||||||||||||||||||||||||||||||
* Адаптировано из рекомендаций NCCLS (документы М 100-S8, М100-S9).
** Стандартные пограничные значения.
1-й этап. Скрининг возможных продуцентов БЛРС. Поскольку БЛРС-продуцирующие штаммы могут проявлять in vitro уровень устойчивости к цефалоспоринам III поколения и монобактамам ниже установленных пограничных значений (чувствительность – умеренная резистентность), в 1999 г. NCCLS были предложены менее строгие критерии выявления штаммов, предположительно экспрессирующих БЛРС (табл. 1).
Тест проводится в стандартных условиях, рекомендуемых NCCLS для определения чувствительности аэробных грамотрицательных бактерий:
- инокулюм – суспензия бактериальных клеток в физиологическом растворе, эквивалентная стандарту мутности 0,5 по МакФарланду;
- инкубирование на агаре Мюллера–Хинтона (для скрининга с использованием дисков) или в бульоне Мюллера–Хинтона, содержащем антибиотики, перечисленные в табл. 1, в концентрации 1 мг/л, в течение 18–20 ч при температуре 35oС.
Интерпретация результатов
Штаммы, устойчивые хотя бы к одному из цефалоспоринов III поколения или азтреонаму в концентрации 1 мг/л рассматриваются как потенциальные продуценты БЛРС. Окончательная интерпретация чувствительности таких штаммов осуществляется на основании результатов теста, подтверждающих наличие БЛРС (2-й этап).
2-й этап. Подтверждающий тест. При использовании дискодиффузионного метода дополнительно определяются диаметры зон подавления роста вокруг дисков, содержащих цефтазидим/клавулановую кислоту (30/10 мкг) и цефотаксим/клавулановую кислоту (30/10 мкг). Для любой из двух перечисленных комбинаций увеличение зоны подавления роста не менее чем на 5 мм по сравнению с таковой при использовании дисков без ингибитора свидетельствует о наличии БЛРС.
При использовании метода разведений в бульоне для штаммов, устойчивых к оксиимино-b-лактамам в концентрации 1 мг/л, определяются точные значения МПК цефтазидима, цефотаксима, а также их комбинаций с клавулановой кислотой в фиксированной концентрации (4 мг/л). Снижение МПК цефтазидима или цефотаксима не менее чем в 8 раз (на 3 последовательных двукратных разведения) в присутствии ингибитора свидетельствует о наличии БЛРС.
Интерпретация результатов
Штаммы с подтвержденным наличием БЛРС рассматриваются как устойчивые ко всем пенициллинам, цефалоспоринам (за исключением цефамицинов) и монобактамам независимо от абсолютных значений МПК и диаметров зон подавления роста вокруг дисков с цефалоспоринами III поколения.
Контроль качества
Анализ испытуемых культур проводят при обязательном параллельном тестировании контрольных штаммов (табл. 2).
Таблица 2. Допустимые значения МПК и зон подавления роста для контрольных штаммов E.coli ATCC®25922 и K.pneumoniae ATCC®700603
| ||||||||||||||||||||||||||||||||||||||||||||||||||
ЦС - цефалоспорин (цефотаксим или цефтазидим), клав - клавулановая кислота.
Примечание
1. Процедура, рекомендуемая NCCLS, может быть использована для обнаружения БЛРС только у штаммов E.coli, K.pneumoniae и K. oxytoca. Критерии оценки МПК и диаметров зон подавления роста, используемые для выявления БЛРС у этих видов, не являются оптимальными для других представителей семейства Enterobacteriaceae.
2. Эффективность обнаружения БЛРС у штаммов E.coli и K.pneumoniae с помощью данного метода составляет ≈80%.
3. Для наиболее эффективного выявления БЛРС на этапе скрининга необходимо использование всех оксиимино-b-лактамов, перечисленных в табл. 1.