Механизмы резистентности к аминогликозидам у нозокомиальных грамотрицательных бактерий в России: результаты многоцентрового исследования
Клиническая Микробиология и Антимикробная Химиотерапия. 2001; 3(2):111-125
Аннотация
Исследовались механизмы резистентности к аминогликозидам у грамотрицательных возбудителей нозокомиальных инфекций в 4 российских стационарах. Основным механизмом устойчивости являлась продукция аминогликозидомодифицирующих ферментов. Выявлены отличия в фенотипах резистентности к аминогликозидам. В Смоленской областной клинической больнице основными фенотипами устойчивости были гентамицин-тобрамицин [54,4% – фермент ANT(2”)] и гентамицин-тобрамицин-нетилмицин [36,1% – фермент AAC(3)-V или комбинация ANT(2”)+AAC(3)-Ia]. В Краснодарской краевой клинической больнице преобладали те же фенотипы устойчивости к аминогликозидам. В Центральной клинической больнице при Управлении делами Президента РФ (Москва) наряду с фенотипами резистентности гентамицин-тобрамицин (29,2%) и гентамицин-тобрамицин-нетилмицин (36,6%) выявлена перекрестная резистентность к аминогликозидам II и III поколений: фенотип устойчивости гентамицин-амикацин-исепамицин [комбинация ферментов APH(3’)-VI+AAC(3)-I] – у 4,9% штаммов, фенотип гентамицин-тобрамицин-амикацин-исепамицин [комбинация ферментов APH(3’)-VI+ANT(2”)] – у 9,8%, фенотип гентамицин-тобрамицин-нетилмицин-амикацин [комбинация ферментов AAC(6’)-I+ANT(2”)] – у 4,9%. В Главном военном клиническом госпитале (ГВКГ) им. Н.Н. Бурденко (Москва) выявлены следующие фенотипы резистентности: гентамицин-тобрамицин [продукция ANT(2”)] – 20,4%, гентамицин-тобрамицин-нетилмицин [AAC(3)-V или комбинация ANT(2”)+AAC(6’)-I] – 24,1%, гентамицин-тобрамицин-нетилмицин-амикацин-исепамицин [комбинация APH(3’)-VI+AAC(3)-V или APH(3’)-VI+ANT(2”)+AAC(6’)-I] – 12,9%, гентамицин-тобрамцин-амикацин-исепамицин [комбинация APH(3’)-VI+ANT(2”)] – 25,9%, амкацин-исепамицин [фермент APH(3’)-VI] – 11,1%.
Введение
Наблюдаемый в последние годы рост частоты нозокомиальных инфекций [1] выдвигает повышенные требования к антибактериальной терапии. Основным фактором, ограничивающим эффективность антибиотиков, является формирование и распространение устойчивой микрофлоры. Несмотря на повышение роли грамположительных микроорганизмов в этиологии нозокомиальных инфекций, аэробные грамотрицательные патогены по-прежнему являются доминирующими в стационарах лечебно-профилактических учреждений России [2, 3].
Самым распространенным подходом к терапии грамотрицательных инфекций является назначение комбинации b-лактамных антибиотиков и аминогликозидов, прежде всего II и III поколений (гентамицина, тобрамицина, нетилмицина, амикацина и исепамицина) [4]. Однако с каждым годом возрастает число случаев неудач терапии нозокомиальных инфекций, вызванных штаммами, устойчивыми к действию этих антибиотиков [5–9].
Наиболее эффективный путь преодоления резистентности микроорганизмов – создание новых препаратов [10]. Однако реализация такого подхода требует определенного времени и значительных материальных затрат. Более реальный путь борьбы с резистентностью – формирование разумной политики применения антибиотиков, основанной на данных об общих и локальных тенденциях распространения детерминант антибиотикорезистентности [11, 12, 13].
Для антибиотиков в целом и аминогликозидов в частности характерна выраженная зависимость распространения детерминант резистентности от локальных особенностей использования препаратов [14, 15]. Рутинная оценка чувствительности к антибиотикам, проводимая в бактериологических лабораториях, не позволяет надежно прогнозировать тенденции распространения устойчивости к аминогликозидам и соответственно осуществлять перспективное планирование выбора антибиотиков [16, 17]. Поэтому большое значение имеет изучение механизмов резистентности к аминогликозидам у клинических изолятов [18, 19].
Основным механизмом устойчивости микроорганизмов к аминогликозидам является модификация молекулы антибиотика бактериальными аминогликозидомодифицирующими ферментами (АГМФ). Фосфорилированные, ацетилированные или аденилированные аминогликозиды не способны эффективно связываться с бактериальными рибосомами и нарушать синтез белка, а следовательно, и жизнедеятельность микробной клетки [20, 21, 22].
Механизмы устойчивости изучаются во многих странах [23, 24, 25]. Институт Schering-Plough (США) организовал исследование резистентности к аминогликозидам в 13 странах и представил их в суммарном обзоре. Результаты исследований показали, что штаммы, продуцирующие АГМФ, широко распространены в клиниках многих стран мира.
Так, например, в Греции преобладают ферменты, модифицирующие нетилмицин и амикацин, в Германии – гентамицин и тобрамицин, а в странах Латинской Америки ферменты, модифицирующие гентамицин, тобрамицин, нетилмицин, амикацин и исепамицин, встречаются с одинаковой частотой [26]. В России имеются только отдельные сообщения о механизмах резистентности к аминогликозидам у клинических изолятов [27].
Материал и методы исследования
В исследование были включены пациенты с нозокомиальными инфекциями, находившиеся на лечении в многопрофильных стационарах – Смоленской областной клинической больнице (СОКБ), Главном военном клиническом госпитале (ГВКГ) им. Н.Н. Бурденко (Москва), Центральной клинической больнице (ЦКБ) при Управлении делами Президента РФ (Москва) и Краснодарской краевой клинической больнице (КККБ). Пациенты лечились в отделениях с интенсивным использованием антибактериальных препаратов: взрослом и детском реанимационных отделениях, отделениях хирургической инфекции и торакальной хирургии, ожоговом и урологическом отделениях.
Отделяемое из ран доставляли в лабораторию в транспортных системах Culturette II и Mini-Tip Culturette (BBL, США), кровь – во флаконах Hemoline (bioMerieux, Франция), мокроту и мочу – в стерильных контейнерах (Sarstedt, Германия). Посев клинического материала проводили на селективные среды МакКонки и Эндо (BBL, США).
Идентификацию микроорганизмов проводили с использованием систем API20E и API20NE (bioMerieux, Франция), определение чувствительности микроорганизмов – согласно рекомендациям Национального комитета по клиническим лабораторным стандартам США (NCCLS) диско-диффузионным методом на агаре Мюллера–Хинтона с помощью дисков с антибиотиками (BBL, США), а также полосок Е-тест (AB Biodisk, Швеция) на агаре PDM ASM II (AB Biodisk, Швеция) [28, 29].
Полученные результаты интерпретировали в соответствии с критериями NCCLS [28, 29]. Контроль качества определения чувствительности проводили с использованием контрольных штаммов из Американской коллекции типовых культур (АТСС) Escherichia coli ATCC 25922 и Pseudomonas aeruginosa ATCC 27853. Для дальнейшего исследования отбирали штаммы, резистентные к одному или более аминогликозидному антибиотику: канамицину, гентамицину и амикацину.
Для определения типов АГМФ использовали фенотипический метод, основанный на соответствии профиля резистентности исследуемого микроорганизма субстратной специфичности вырабатываемого фермента. Для этого использовали диски с 12 аминогликозидами: фортимицином (Fm, 100 мкг/диск), 6’-этилнетилмицином (6Nt, 100 мкг), 2’-этилнетилмицином (2Nt, 100 мкг), 5-ОH-эписизомицином (5Ss, 10 мкг), апрамицином (Am, 100 мкг), исепамицином (Im, 30 мкг), амикацином (30 мкг), гентамицином (10 мкг), тобрамицином (10 мкг), неомицином (30 мкг), нетилмицином (Nt, 30 мкг) и канамицином (30 мкг).
Диски с фортимицином, 6’-этилнетилмицином, 2’-этилнетилмицином, 5-ОH-эписизомицином, апрамицином были предоставлены профессором G. Miller (Schering Corp., Bloomfield, N.J., США). Диски с исепамицином, амикацином, гентамицином, тобрамицин, неомицином, нетилмицином и канамицином были коммерческого изготовления (BBL, США).
Дополнительно для изучения типов продуцируемых штаммами аминогликозидфосфотрансфераз с помощью метода разведения в агаре определяли минимальную подавляющую концентрацию (МПК) ливидомицина (Lm) и бутирозина (Bt) для тестируемых возбудителей. Типы АГМФ определяли по методике G. Miller (США) [30].
Принцип определения изложен в табл. 1.
Таблица 1. Определение типов аминогликозидомодифицирующих ферментов на основании субстратной специфичности *
| Аминогликозид | NT(2”) | AAC(6’)-I | AAC(3)-I | AAC(3)-Ia | AAC(3)-V | APH(3’)-I | APH(3’)-II | APH(3’)-VI |
|---|---|---|---|---|---|---|---|---|
| Гентамицин | + | + | + | + | + | - | - | - |
| Тобрамицин | + | + | - | - | + | - | - | - |
| Амикацин | - | + | - | - | - | - | - | + |
| Нетилмицин | - | + | - | + | + | - | - | - |
| Изепамицин | - | + | - | - | - | - | - | + |
| 2’-Этилнетилмицин | - | + | - | + | + | - | - | - |
| 6’-Этилнетилмицин | - | - | - | + | + | - | - | - |
| Фортимицин | - | - | + | - | - | - | - | - |
| Апрамицин | - | - | - | - | - | - | - | - |
| 5-ОН-Эписизомицин | - | + | - | - | - | - | - | - |
| Kанамицин | + | - | - | - | - | + | + | + |
| Неомицин | - | - | - | - | - | + | + | + |
| Ливидомицин | - | - | - | - | - | + | - | - |
| Бутирозин | - | - | - | - | - | - | + | - |
Плюс (+) - является субстратом для фермента, минус (-) - не является субстратом, плюс-минус (+) - признак не постоянен.
Несколько не применяемых в практике аминогликозидов (2’-этилнетилмицин и 6’-этилнетилмицин) были включены для того чтобы точно определить различные механизмы резистентности, обусловленной продукцией ферментов AAC(2’), AAC(6’), AAC(3)-V и ANT(2”), поскольку эти антибиотики имеют 2’- и 6’-аминогруппы соответственно инвертированно по сравнению с нетилмицином (табл. 2).
Таблица 2. Отличия некоторых ацетилтранфераз и ANT(2”) на основании субстратной специфичности
| Фермент | Нетилмицин | 2’-Этилнетилмицин | 6’-Этилнетилмицин |
|---|---|---|---|
| AAC(3)-V | + | + | + |
| AAC(2’) | + | - | + |
| AAC(6’)-I | + | + | - |
| ANT(2”) | - | - | - |
5-Эписизомицин был включен для отличия между ANT(2”) и AAC(3)-III – ферментов, которые оба инактивируют гентамицин, тобрамицин и канамицин. В результате инверсии гидроксильной группы в положении 5 второго кольца 5-эписизомицин является плохим субстратом для ANT(2”)-I, но инактивируется ацетилтрансферазой AAC(3)-III (табл. 3). К тому же 5-эписизомицин является плохим субстратом для AAC(2’), AAC(3)-I, AAC(3)-VI, но может быть использован для выявления продукции AAC(3)-V и AAC(6’)-I и AAC(6’)-II.
Таблица 3. Отличие ANT(2”) от AAC(3)-III на основании субстратной специфичности
| Фермент | Гентамицин | Тобрамицин | Канамицин | 5-Эписизомицин |
|---|---|---|---|---|
| ANT(2”)-I | + | + | + | - |
| AAC(3)-III | + | + | + | + |
Фортимицин и апрамицин использовались для выявления нарушения проницаемости наружной клеточной мембраны или для определения ферментов, которые могут модифицировать фортимицин или апрамицин (табл. 4).
Таблица 4. Отличия ацетилтрансфераз AAC(3)-I от AAC(3)-IV по их субстратной специфичности
| Механизм резистентности | Фортимицин | Апрамицин |
|---|---|---|
| AAC(3)-I | + | - |
| AAC(3)-IV | - | + |
| Нарушение проницаемости | + | + |
Важный принцип определения АГМФ (с использованием метода AGRP) – исследование не абсолютной, а изменения относительной активности ко всем 12 аминогликозидам.
Для подтверждения результатов, полученных фенотипическим методом, а также возможного выявления резистентности, связанной с изменением мишени действия аминогликозидов (рибосомальной РНК), была проведена ДНК–ДНК гибридизация на фильтрах Nen фирмы «Du Pont» (США) по методу T. Gootz et al. Для получения радиоактивно-меченных зондов использовали 0,2–0,4 мкг ДНК фрагментов, ник-трансляционный набор «Amersham» (Великобритания) и дезокси-[g-32P]-ЦТФ отечественного производства, а в качестве ДНК-зондов – внутренние фрагменты генов, кодирующих следующие АГМФ: ANT(2”), AAC(3)-V, APH(3’)-I (полученные в лаборатории ГНЦА).
Все исследованные штаммы были параллельно тестированы с помощью метода ДНК–ДНК гибридизации в Институте Schering-Plough (США) с использованием зондов ANT-2”-a, AAC-3-I, AAC-3-Va, AAC-3-Vb, AAC-2’-Ia, AAC-6’-Ib, AAC-6’-Ic, APH-3’-I, APH-3’-II, APH-3’-VI, ANT-4’-II, ANT-3”, ANT-4’-I, APH-2”+6’, APH-3’-III, AAC-3-IV, AAC-6’-Ia, ANT-6-Ia, AAC-3-Ib, AAC-6’-IIb, AAC-6’-If, r-RNA.
Результаты исследования
Всего в исследование было включено 569 пациентов с нозокомиальными инфекциями, из них в СОКБ – 289, в ГВКГ им. Н.Н. Бурденко – 93, в ЦКБ – 95, в КККБ – 92. Уровень резистентности выделенных грамотрицательных бактерий к гентамицину в СОКБ составил в 1993 г. 74%, в 1994 г. – 77%, в 1995 г. – 71%. В КККБ устойчивость к гентамицину в 1995 г. составила 69%. В ЦКБ частота резистентности к гентамицину составила в 1995 г. 58%, к амикацину – 10%. В ГВКГ им. Н.Н. Бурденко частота резистентности у госпитальных аэробных грамотрицательных штаммов к гентамицину составила 46%, к амикацину – 29%.
Смоленская областная клиническая больница
Для исследования механизмов резистентности грамотрицательных бактерий, выделенных в СОКБ, были отобраны 158 штаммов. Из них 101 – представители семейства Enterobacteriaceae (Escherichia coli – 6, Enterobacter spp. – 11, Klebsiella pneumoniae – 50, Proteus mirabilis – 34), 21 штамм Acinetobacter spp. и 36 штаммов Pseudomonas aeruginosa.
Из всех исследованных штаммов 155 (98,1%) были устойчивы к гентамицину в результате продукции различных АГМФ. Наиболее распространенными ферментами явились ANT(2”) и AAC(3)-V, которые были определены у 90,5% исследованных штаммов: у 54,4 и 36,1% соответственно. Нуклеотидилтрансфераза ANT(2”) обусловливала перекрестную резистентность к гентамицину и тобрамицину. В результате продукции ацетилтрансферазы AAC(3)-V штаммы обладали перекрестной устойчивостью к гентамицину, тобрамицину и нетилмицину, а также к полусинтетическим производным нетилмицина – к 2’-этилнетилмицину и 6’-этилнетилмицину.
Резистентность к канамицину, неомицину, мономицину и ливидомицину в результате продукции фермента фосфотрансферазы APH(3’)-I отмечена у 113 (71,5%) штаммов, из них 6 изолятов были также резистентны к бутирозину за счет дополнительной продукции APH (3’)-II.
Резистентность к амикацину выявили лишь у 7 (4,4%) тестированных штаммов, что было обусловлено ферментом APH(3’)-VI. Все эти штаммы были также устойчивы к канамицину и исепамицину за счет продукции данного фермента.
Большинство микроорганизмов продуцировало два фермента, в некоторых случаях – три (в различных комбинациях). Наиболее частыми комбинациями ферментов явились ANT(2”)+APH(3’)-I и AAC(3)-V+APH(3’)-I. Из 87 штаммов, продуцировавших нуклеотидилтрансферазу ANT(2”), 56 (64,4%) одновременно вырабатывали APH(3’)-I. Таким образом, эти микроорганизмы были одновременно устойчивы к канамицину, неомицину, гентамицину и тобрамицину.
Из 55 штаммов, вырабатывавших ацетилтрансферазу AAC(3)-V, 47 (85,5%) одновременно продуцировали фосфотрансферазу APH(3’)-I и обладали резистентностью к канамицину, неомицину, гентамицину, тобрамицину, нетилмицину, то есть к большинству аминогликозидов I и II поколений.
Достаточно редкой оказалась комбинация трех ферментов APH(3’)-VI+AAC(3)-I+APH(3’)-I, которая выявлялась у 7 штаммов и которые в результате были одновременно устойчивы к большинству аминогликозидов всех трех поколений – канамицину, неомицину, гентамицину, амикацину и исепамицину. Остальные комбинации АГМФ встречались у отдельных изолятов.
Как видно из данных рис. 1, основными фенотипами устойчивости у грамотрицательных нозокомиальных возбудителей в СОКБ явились гентамицин-тобрамицин и гентамицин-тобрамицин-нетилмицин.
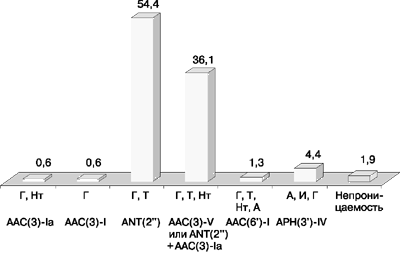
Г - гентамицин, Т - тобрамицин, Нт - нетилмицин, И - исепамицин
Отмечены определенные отличия в типах АГМФ и их комбинаций у различных семейств грамотрицательных бактерий, а также в пределах одного семейства между родами.
P. aeruginosa, n=36 (табл. 5). Один штамм был резистентен ко всем аминогликозидам за счет непроницаемости наружной клеточной мембраны, другой штамм обладал устойчивостью к аминогликозидам I поколения – канамицину и неомицину в результате продукции APH(3’)-I, но был чувствителен к аминогликозидам II и III поколений – гентамицину, тобрамицину, нетилмицину, амикацину и исепамицину.
Таблица 5. Механизмы резистентности к аминогликозидам у P. aeruginosa в Смоленской областной клинической больнице
| Механизм резистентности | Фенотип резистентности | Число (%) штаммов |
|---|---|---|
| ANT(2”) | К, Г, Т | 26⁄36 (72,2) |
| +APH(3’)-I | К, Г, Т, Н | 15⁄26 (57,7) |
| AAC(3)-V | К, Г, Нт | 8⁄36 (22,2) |
| +APH (3’)-I | К, Г, Т, Нт, Н | 6⁄8 (75,0) |
| +APH(3’)-I | К, Н | 1⁄36 (2,8) |
| Непроницаемость | К, Н, Г, Т, Нт, А, И | 1⁄36 (2,8) |
Примечание: К - канамицин, Н - неомицин, Г - гентамицин, Т - тобрамицин, Нт - нетилмицин, А - амикацин, И - исепамицин.
Обладали устойчивостью к гентамицину в результате продукции различных ферментов 34 штамма. Из них большая часть, 26 (76,5%), вырабатывала фермент ANT(2”) и характеризовалась одновременной резистентностью к тобрамицину и канамицину, 15 (57,7%) из 26 были также устойчивы к неомицину в результате одновременной продукции APH(3’)-I. Остальные 8 (23,5%) гентамицинорезистентных штаммов были также нечувствительны к тобрамицину, нетилмицину в результате выработки ацетилтрансферазы AAC(3)-V, из них у 6 (75,0%) отмечалась устойчивость к канамицину и неомицину за счет продукции APH(3’)-I.
Таким образом, из 36 исследованных штаммов P. aeruginosa 35 (97,2%) обладали перекрестной резистентностью к гентамицину и тобрамицину, причем 1 – в результате непроницаемости, а 34 – за счет выработки АГМФ.
Только один из исследованных штаммов P. aeruginosa был резистентен к амикацину и исепамицину, однако не за счет продукции АГМФ, а в результате непроницаемости наружной клеточной мембраны.
P. mirabilis, n=34 (табл. 6). Все изученные штаммы были устойчивы к гентамицину. Однако большая часть (79,4%) обладала перекрестной резистентностью к тобрамицину и нетилмицину за счет продукции фермента AAC(3)-V, а 6 изолятов – только к тобрамицину в результате выработки ANT(2”). Из 27 штаммов, продуцировавших ацетилтрансферазу AAC(3)-V, 25 (92,6%) были резистентны к канамицину и неомицину за счет дополнительной выработки APH(3’)-I, а 6 – одновременно продуцировали APH(3’)-II. Следует отметить, что в данном исследовании продукцию фосфотрансферазы APH(3’)-II наблюдали только у Proteus spp.
Таблица 6. Механизмы резистентности к аминогликозидам у P. mirabilis в Смоленской областной клинической больнице
| Механизм резистентности | Фенотип резистентности | Число (%) штаммов |
|---|---|---|
| ANT(2”) | К, Г, Т | 6⁄34 (17,6) |
| +APH(3’)-I | К, Г, Т, Н | 5⁄6 (83,3) |
| AAC(3)-V | Г, Т, Нт | 27⁄34 (79,4) |
| +APH (3’)-I | К, Г, Т, Нт, Н | 25⁄27 (92,6) |
| +APH(3’)-II | К, Г, Т, Нт, Н | 6⁄25 (24,0) |
| Непроницаемость | К, Н, Г, Т, Нт, А, И | 1⁄34 (2,9) |
Примечание: К - канамицин, Н - неомицин, Г - гентамицин, Т - тобрамицин, Нт - нетилмицин, А - амикацин, И - исепамицин.
Практически все штаммы (5 из 6), резистентные к гентамицину и тобрамицину, оказались также устойчивыми к канамицину и неомицину – выработка APH(3’)-I. Только один штамм был полностью резистентен ко всем амино-гликозидам в результате непроницаемости наружной клеточной стенки. Не выявлено ни одного изолята, вырабатывающего амикациномодифицирующие и исепамициномодифицирующие ферменты (табл. 6).
Таким образом, хотя основные фенотипы резистентности у P. mirabilis были подобны фенотипам, определенным у P. aeruginosa, у бактерий рода Proteus гораздо выше был процент штаммов, устойчивых к нетилмицину.
E.coli, n=6. Из 6 штаммов 5 были резистентными к гентамицину и тобрамицину за счет выработки двух типов ферментов – ANT(2”) и AAC(3)-V. Причем один из штаммов, продуцировавших AAC(3)-V, вырабатывал также APH(3’)-I и был резистентен к канамицину и неомицину. Один штамм продуцировал ацетилтрансферазу AAC(3)-I – вместе с APH(3’)-I. В результате он был устойчив к гентамицину, канамицину и неомицину, но тобрамицин, нетилмицин, амикацин и исепамицин проявляли к нему хорошую активность.
K.pneumoniae, n=50 (табл. 7). Основным ферментом, вырабатываемым K.pneumoniae, был ANT(2”) – 43 (86%), что приводило к нечувствительности к канамицину, гентамицину и тобрамицину. Больше половины этих бактерий – 27 (62,8%) – были также резистентны и к неомицину – одновременная продукция APH(3’)-I.
Таблица 7. Механизмы резистентности к аминогликозидам у K.pneumoniae в Смоленской областной клинической больнице
| Механизм резистентности | Фенотип резистентности | Число (%) штаммов |
|---|---|---|
| ANT(2”) | К, Г, Т | 43⁄50 (86,0) |
| +APH(3’)-I | К, Г, Т, Н | 27⁄43 (62,8) |
| +AAC(3)-V | К, Г, Т, Нт | 1⁄43 (2,3) |
| AAC(3)-V +APH (3’)-I | К, Г, Т, Нт, Н | 7⁄50 (14,0) |
| +AAC(3)-I | К, Г, Т, Нт, Н | 1⁄7 (14,3) |
Примечание: К - канамицин, Н - неомицин, Г - гентамицин, Т - тобрамицин, Нт - нетилмицин.
Другим значимым механизмом резистентности явилась выработка фермента AAC(3)-V у 8 (16%) штаммов, обусловившая перекрестную устойчивость к гентамицину, тобрамицину и нетилмицину. Из них 7 штаммов были также нечувствительны к канамицину и неомицину – продукция APH(3’)-I. У одного штамма отмечена довольно редкая комбинация ANT(2”) и AAC(3)-V. Резистентность к гентамицину и фортимицину за счет ацетилтрансферазы AAC(3)-I установлена лишь у одного штамма K.pneumoniae. Он был также резистентен к тобрамицину, нетилмицину – одновременная продукция AAC(3)-V канамицину и неомицину – выработка APH(3’)-I.
Enterobacter spp., n=11 (табл. 8). Большинство штаммов Enterobacter spp. (81,8%) оказалось нечувствительными к гентамицину, тобрамицину и нетилмицину в результате выработки ацетилтрансферазы AAC(3)-V. Из них 6 также не были чувствительны к аминогликозидам I поколения – канамицину и неомицину, что обусловлено продукцией APH(3’)-I.
Таблица 8. Механизмы резистентности к аминогликозидам у Enterobacter spp. в Смоленской областной клинической больнице
| Механизм резистентности | Фенотип резистентности | Число (%) штаммов |
|---|---|---|
| AAC(3)-V | Г, Т, Нт | 9⁄11 (81,8) |
| +APH(3’)-I | К, Г, Т, Нт, Н | 7⁄9 (77,8) |
| +ANT(2”) | К, Г, Т, Нт, Н | 1⁄9 (11,1) |
| AAC(6’)-I + APH(3’)-I + AAC(3)-I | К, Г, Т, Нт, Н, A | 2⁄9 (22,2) |
Примечание: К - канамицин, Н - неомицин, Г - гентамицин, Т - тобрамицин, Нт - нетилмицин, А - амикацин.
Необходимо отметить, что 2 штамма Enterobacter spp. продуцировали фермент, который не был характерен для других представителей семейства Enterobacteriaceae, – ацетилтрансферазу AAC(6’)-I, обусловливающую перекрестную резистентность к тобрамицину, нетилмицину, канамицину и значительно снижающую активность амикацина.
Кроме того, эти штаммы были одновременно устойчивы к гентамицину в результате выработки AAC(3)-I, а также к канамицину и неомицину за счет фосфотрансферазы APH(3’)-I.
Acinetobacter spp., n=21 (табл. 9). Из 21 штамма Acinetobacter spp. 7 (33,3%) были высокорезистентными к амикацину, исепамицину и канамицину за счет продукции фосфотрансферазы APH(3’)-VI. Они были устойчивыми к гентамицину в результате продукции AAC(3)-I и к неомицину – благодаря выработке APH(3’)-I, а также умеренно резиcтентными к остальным аминогликозидам за счет снижения проницаемости наружной клеточной мембраны.
Таблица 9. Механизмы резистентности к аминогликозидам у Acinetobacter spp. в Смоленской областной клинической больнице
| Механизм резистентности | Фенотип резистентности | Число (%) штаммов |
|---|---|---|
| ANT(2”) | К, Г, Т | 11⁄21 (52,4) |
| +APH(3’)-I | К, Г, Т, Н | 9⁄11 (81,8) |
| +AAC(3)-Ia +APH(3’)-I | К, Г, Т, Нт, Н | 1⁄11 (9,1) |
| AAC(3)-V +APH(3’)-I | К, Н, Г, Т, Нт | 1⁄21 (4,8) |
| AAC(3)-I +AAC(3)-Ia +APH(3’)-I | К, Н, Г, Нт | 1⁄21 (4,8) |
| APN(3’)-VI +AAC(3)-I +APH(3’)-I +Снижение проницаемости | А, И, Г, К, Н | 7⁄21 (33,3) |
| Непроницаемость клеточной оболочки | К, Н, Г, Т, Нт, А, И | 1⁄21 (4,8) |
Примечание: К - канамицин, Н - неомицин, Г - гентамицин, Т - тобрамицин, Нт - нетилмицин, А - амикацин, И - исепамицин.
Один (4,8%) штамм был нечувствителен ко всем аминогликозидам в результате непроницаемости наружной клеточной мембраны, 11 (52,4%) штаммов – к канамицину, гентамицину и тобрамицину в результате продукции фермента ANT(2”), причем 10 (90,9%) из них отличались также устойчивостью к неомицину за счет выработки APH(3’)-I, но сохраняли чувствительность к нетилмицину, амикацину и иcепацину.
Резистентны к канамицину, неомицину, гентамицину, тобрамицину и нетилмицину были 2 штамма: один продуцировал комбинацию ферментов AAC(3)-V и APH(3’)-I, второй – комбинацию ферментов AAC(3)-Ia, ANT(2”) и APH(3’)-I.
Краснодарская краевая клиническая больница
Всего в КККБ было исследовано 59 устойчивых к аминогликозидам клинических изолятов грамотрицательных бактерий: Acinetobacter spp. – 7, Alcaligenes faecalis – 1, Citrobacter freundii – 1, E.coli – 1, Enterobacter spp. – 2, K.pneumoniae – 6, P. aeruginosa – 33, Proteus spp. – 8.
Как следует из данных табл. 10, основными типами продуцируемых ферментов явились ANT(2”) – 47,5% и AAC(3)-V – 33,9%. В результате выработки этих типов ферментов, а также AAC(3)-IV и AAC(6’)-II из 59 штаммов 52 (88,1%) обладали перекрестной резистентностью к гентамицину и тобрамицину.
Таблица 10. Механизмы резистентности к аминогликозидам у грамотрицательных бактерий в Краснодарской краевой клинической больнице
| Механизм резистентности | Фенотип резистентности | Число (%) штаммов |
|---|---|---|
| ANT(2”) | К, Г, Т | 28⁄59 (47,5) |
| +APH(3’)-I и/или APH(3’)-II | К, Н, Г, Т | 26⁄28 (92,9) |
| +APH(3’)-I +AAC(3)-Ia | К, Н, Г, Т, Нт | 3⁄26 (11,5) |
| +AAC(3)-I | К, Н, Г, Т, Нт | 1⁄3 |
| +APH(3’)-VI | К, Н, Г, Т, Нт, А, И | 1⁄3 |
| AAC(3)-V +APH(3’)-I и/или APH(3’)-II | К, Н, Г, Т, Нт | 20⁄59 (33,9) |
| AAC(3)-I +APH(3’)-II | К, Н, Г | 2⁄59 (3,4) |
| AAC(3)-I +AAC(3)-Ia +APH(3’)-I | К, Н, Г, Нт | 1⁄59 (1,7) |
| AAC(3)-IV | Г, Т, Нт | 2⁄59 (3,4) |
| AAC(6’)-II +APH(3’)-II | К, Н, Г, Т, Нт | 2⁄59 (3,4) |
| APH(3’)-II | К, Н | 4⁄59 (6,8) |
Примечание: К - канамицин, Н - неомицин, Г - гентамицин, Т - тобрамицин, Нт - нетилмицин, А - амикацин, И - исепамицин.
Ацетилтрансферазы AAC(3)-V, AAC(3)-IV и AAC(6’)-II обусловили у 24 (40,7%) штаммов одновременную устойчивость к нетилмицину. Большинство (92,3%) гентамицино- и тобрамицинорезистентных штаммов обладали устойчивостью к канамицину и неомицину, так как вырабатывали фосфотрансферазы APH(3’)-I и APH(3’)-II. Только один штамм (Acinetobacter spp.) был резистентен к амикацину и исепамицину в результате продукции APH(3’)-VI.
Резистентностью к гентамицину [продукция AAC(3)-I], канамицину и неомицину [выработка APH(3’)-II] при сохранении чувствительности к остальным аминогликозидам (тобрамицину, нетилмицину, амикацину и исепамицину) отличались 2 из штамма: у одного отмечалась резистентность гентамицину и нетилмицину [продукция AAC(3)-Ia] и к аминогликозидам I поколения [APH(3’)-I] при сохранении чувствительности к тобрамицину, амикацину и исепамицину.
На рис. 2 представлены фенотипы резистентности к аминогликозидам II и III поколений, полученные у клинических изолятов в КККБ.
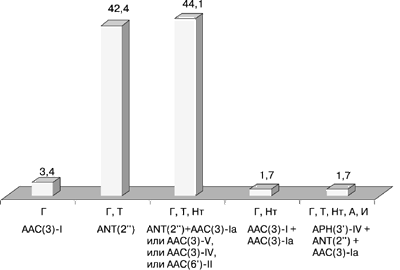
Г - гентамицин, Т - тобрамицин, Нт - нетилмицин, А - амикацин, И - исепамицин
Центральная клиническая больница при Управлении делами Президента РФ (Москва)
Для определения механизмов резистентности был отобран 41 штамм грамотрицательных бактерий: Acinetobacter spp. – 6, E.coli – 3, Enterobacter spp. – 3, K.pneumoniae – 4, P. aeruginosa – 19, P. mirabilis – 3, Serratia spp. – 3.
Как видно из данных табл. 11, основным фенотипом резистентности в ЦКБ оказался гентамицин-тобрамицин-нетилмицин, обусловленный выработкой ацетилтрансферазы AAC(3)-V. Этот фенотип резистентности выявлен у 13 (31,7%) штаммов, причем 11 (84,6%) из них были также устойчивы к канамицину и неомицину за счет продукции фосфотрансфераз APH(3’)-I или APH(3’)-II, или обеих сразу. Однако один из этих штаммов сохранял чувствительность к неомицину, но был но резистентен к канамицину [ANT(2”)].
Таблица 11. Механизмы резистентности к аминогликозидам у грамотрицательных бактерий в Центральной клинической больнице при Управлении делами Президента РФ
| Механизм резистентности | Фенотип резистентности | Число (%) штаммов |
|---|---|---|
| AAC(3)-V | Г, Т, Нт | 13⁄41 (31,7) |
| +APH(3’)-I или APH(3’)-II | К, Г, Т, Нт, Н | 9⁄13 (69,2) |
| +APH(3’)-I или APH(3’)-II +ANT(2”) | К, Г, Т, Нт, Н | 2⁄13 (15,4) |
| +ANT(2”) | К, Г, Т, Нт | 1⁄13 (7,7) |
| ANT(2”) | К, Г, Т | 14⁄41 (34,1) |
| +APH(3’)-I или APH(3’)-II | К, Н, Г, Т | 10⁄14 (71,4) |
| +AAC(3)-Ia | К, Г, Нт, Т | 1⁄14 (7,1) |
| +AAC(3)-I +APH(3’)-I | К, Н, Г, Нт, Т | 1⁄14 (7,1) |
| APH(3’)-VI +AAC(3)-I +APH(3’)-II | К, Н, Г, А, И | 2⁄41 (4,9) |
| +AAC(3)-Ia +APH(3’)-I +ANT(2”) | К, Н, Г, Т, А, И | 4⁄41 (9,8) |
| AAC(6’)-I +ANT(2”) +APH(3’)-I | К, Н, Г, Т, Нт, А | 2⁄41 (4,9) |
| AAC(3)-I +APH(3’)-II Г, К, Н 1⁄41 (2,4) APH(3’)-I | К, Н | 5⁄41 (12,2) |
Примечание: К - канамицин, Н - неомицин, Г - гентамицин, Т - тобрамицин, Нт - нетилмицин, А - амикацин, И - исепамицин.
Резистентностью к гентамицину, тобрамицину и канамицину отличались 12 (29,3%) штаммов, но были чувствительны к нетилмицину, так как вырабатывали аденилилтрансферазу ANT(2”), причем 10 из них были также устойчивы к неомицину [продукция APH(3’)-I или APH(3’)-II]. Эти бактерии оказались чувствительными к амикацину и иcепамицину. Один штамм был резистентен только к одному из аминогликозидов II поколения – гентамицину – в результате продукции AAC(3)-I и к аминогликозидам I поколения – канамицину и неомицину – за счет фермента APH(3’)-II. При этом он сохранял чувствительность к тобрамицину, нетилмицину, амикацину и иcепамицину.
Устойчивость только к аминогликозидам I поколения – канамицину и неомицину – наблюдали у 4 (9,8%) изолятов в результате выработки APH(3’)-I. Резистентность к амикацину была выявлена у 8 (19,5%) госпитальных грамотрицательных бактерий, из них 2 штамма P. aeruginosa и 4 штамма Acinetobacter spp. проявляли устойчивость и к исепамицину [обусловлено фосфотрансферазой APH(3’)-VI]. Эти изоляты P. aeruginosa отличались также нечувствительностью к гентамицину в результате выработки AAC(3)-I и к канамицину и неомицину за счет продукции APH(3’)-II. Однако они сохраняли чувствительность к тобрамицину и нетилмицину.
Амикацинорезистентные штаммы Acinetobacter spp. характеризовались одновременной устойчивостью ко всем используемым в клинической практике аминогликозидам I и II поколений, так как вырабатывали еще 3 типа модифицирующих ферментов: AAC(3)-Ia, ANT(2”) и APH(3’)-I. Остальные 2 штамма сохраняли чувствительность к амикацину и иcепамицину, в то же время были устойчивы к гентамицину, тобрамицину, канамицину [ANT(2”)] и нетилмицину [AAC(3)-Ia], а один из них – к неомицину [APH(3’)-I].
Резистентные к амикацину 2 изолята Serratia spp. сохраняли чувствительность к иcепамицину, но были устойчивы к тобрамицину, нетилмицину и канамицину [за счет фермента AAC(6’)-I], к гентамицину (ANT(2”)) и к неомицину [APH(3’)-I]. Полученные в данном стационаре фенотипы резистентности к аминогликозидам II и III поколений представлены на рис. 3.
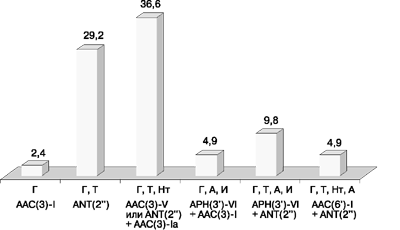
Г - гентамицин, Т - тобрамицин, Нт - нетилмицин, А - амикацин, И - исепамицин
Главный военный клинический госпиталь им. Н.Н. Бурденко (Москва)
В ГВКГ им. Н.Н. Бурденко исследованы 54 резистентных к аминогликозидам штаммов грамотрицательных бактерий: Acinetobacter anitratus – 2, C. freundii – 2, E.coli – 5, Enterobacter spp. – 2, K.pneumoniae – 15, Morganii morganii – 6, P. aeruginosa – 5, P. mirabilis – 17.
Основным ферментом, продуцируемым данными микроорганизмами, явилась модифицирующая амикацин, иcепамицин и канамицин фосфотрансфераза APH(3’)-VI в различных сочетаниях с ферментами, способными инактивировать аминогликозиды II поколения.
Резистентность к амикацину и иcепамицину за счет продукции фермента APH(3’)-VI выявлена у 26 (48,1%) исследованных штаммов, из них 14 (53,8%) были устойчивы одновременно к гентамицину и тобрамицину в результате действия аденилилтрансферазы ANT(2”), а 6 (23,1%) – к гентамицину, тобрамицину и нетилмицину в результате выработки фермента AAC(3)-V.
Резистентность к гентамицину и тобрамицину при сохранении чувствительности к аминогликозидам III поколения выявлена лишь у 24 (44,4%) изолятов, из них у 12 – в результате продукции ANT(2”), у остальных 12 – AAC(3)-V (они также оказались устойчивыми к нетилмицину).
Два штамма были резистентны к аминогликозидам 3 поколений в результате непроницаемости наружной клеточной мембраны: один штамм – только к гентамицину за счет ацетилтрансферазы AAC(3)-I, другой – только к аминогликозидам I поколения, таким, как канамицин и неомицин [продукция APH(3’)-I], и был чувствителен ко всем остальным аминогликозидам (табл. 12).
Таблица 12. Механизмы резистентности к аминогликозидам у грамотрицательных бактерий в Главном военном клиническом госпитале им. Н.Н. Бурденко
| Механизм резистентности | Фенотип резистентности | Число (%) штаммов |
|---|---|---|
| APH(3’)-VI | К, А, И | 26⁄54 (48,1) |
| +ANT(2”) | К, Г, Т, А, И | 14⁄26 (53,8) |
| +APH(3’)-I | К, Н, Г, Т, А, И | 7⁄14 (50,0) |
| +AAC(6’)-I | К, Н, Г, Т, Нт, А, И | 1⁄14 (7,1) |
| +AAC(3)-V | К, Г, Т, А, И, Нт, Н | 6⁄26 (23,1) |
| +AAC(3)-I +APH(3’)-I | К, Н, Г, Т, Нт, А, И | 2⁄6 |
| AAC(3)-V +APH(3’)-I | К, Н, Г, Т, Нт | 12⁄54 (22,2) |
| ANT(2”) | К, Г, Т | 12⁄54 (22,2) |
| +AAC(6’)-I | К, Г, Т, Нт | 1⁄2 |
| AAC(3)-I | Г | 1⁄54 (1,9) |
| APH(3”)-I | К, Н | 1⁄54 (1,9) |
| Непроницаемость | К, Н, Г, Т, Нт, А, И | 2⁄54 (3,7) |
Примечание: К - канамицин, Н - неомицин, Г - гентамицин, Т - тобрамицин, Нт - нетилмицин, А - амикацин, И - исепамицин.
Фенотипы резистентности к аминогликозидам II и III поколений показаны на рис. 4.
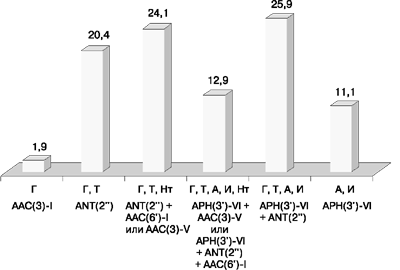
Г - гентамицин, Т - тобрамицин, Нт - нетилмицин, А - амикацин, И - исепамицин
Корреляция между AGRP и ДНК–ДНК гибридизацией
Обнаружена 100% корреляция результатов определения ферментов, полученных с использованием метода ДНК–ДНК гибридизации и фенотипического метода.
Использование специальных зондов, представляющих внутренние фрагменты генов рРНК, не позволило выявить штаммы, резистентность которых была бы связана с изменением мишени действия аминогликозидов. Этот факт подтвердил предположение о том, что резистентность к аминогликозидным антибиотикам у исследованных штаммов обусловливалась преимущественно продукцией аминогликозидомодифицирующих ферментов.
Распространенность фенотипов резистентности к аминогликозидам в стационарах лечебно-профилактических учреждений
В результате продукции одного или комбинации различных ферментов микроорганизмы обладали определенными фенотипами устойчивости к аминогликозидам. Отмечено сходство в фенотипах резистентности, выявленных в СОКБ, ЦКБ (Москва), ГВКГ им. Н.Н. Бурденко (Москва) и КККБ. Так, монорезистентность к гентамицину при сохранении чувствительности ко всем остальным аминогликозидам II и III поколений выявлена только у 1 (0,6%) штамма в СОКБ, у 1 (2,4%) штамма в ЦКБ, у 1 (1,9%) штамма в ГКВГ им. Н.Н. Бурденко и у 2 (3,4%) штаммов в КККБ (рис. 5).
Перекрестная резистентность к гентамицину и нетилмицину при сохранении чувствительности к остальным аминогликозидам II и III поколений также выявлялась редко в исследованных стационарах. Такой фенотип резистентности установлен только у 1 (0,6%) штамма в СОКБ и у 1 (1,7%) штамма в КККБ. В двух других стационарах этот фенотип не выявлен.
Чаще встречающимися фенотипами резистентности оказались Г, Т (гентамицин, тобрамицин) и Г, Т, Нт (гентамицин, тобрамицин, нетилмицин). Однако процентное соотношение этих фенотипов резистентности варьировало (рис. 6). Так, Г, Т фенотип резистентности выявлен в СОКБ у 86 (54,4%) штаммов, в ЦКБ – у 12 (29,2%), в КККБ – у 25 (42,4%), в ГВКГ им. Н.Н. Бурденко – у 11 (20,4%). У всех изолятов он обусловливался продукцией фермента ANT(2І).
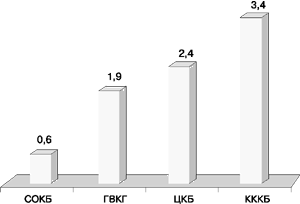
Рис. 5. Частота монорезистентности к гентамицину, %
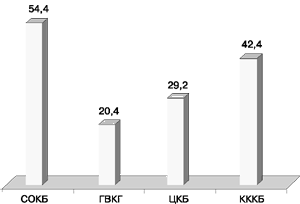
Рис. 6. Частота фенотипа резистентности гентамицин-тобрамицин, %
Фенотип резистентности Г, Т, Нт (гентамицин, тобрамицин, нетилмицин) встречался примерно с такой же частотой и обусловливался продукцией либо фермента AAC(3)-V, либо комбинацией ANT(2”)+AAC(3)-Ia (рис. 7).
Фенотип резистентности Г, Т, Нт, А (гентамицин, тобрамицин, нетилмицин, амикацин) выявлялся редко (рис. 8). Только 2 (1,3%) штамма в СОКБ и 2 (4,9%) штамма в ЦКБ имели этот фенотип резистентности в результате продукции комбинации ферментов AAC(6’)-I+ANT(2”), в то время как в КККБ и ГКВГ им. Н.Н. Бурденко этот фенотип не обнаружен.
Фенотип резистентности Г, А, И (гентамицин, амикацин, исепамицин), обусловленный продукцией фермента APH(3’)-VI, выявлен только в СОКБ у 7 (4,4%) штаммов и в ЦКБ – у 2 (4,9%), но отсутствовал в КККБ и в ГКВГ им. Н.Н. Бурденко.
В результате продукции комбинации APH(3’)-VI+ANT(2”) только 4 (9,8%) штамма в ЦКБ имели фенотип резистентности Г, Т, А, И (гентамицин, тобрамицин, амикацин, иcепамицин). В ГВКГ им. Н.Н. Бурденко этот фенотип резистентности выявлен у 14 (25,9%) штаммов (рис. 9). В остальных лечебно-профилактических учреждениях он не выявлен.
Распространенный в ГВКГ им. Н.Н. Бурденко фенотип резистентности Г, Т, А, И, Нт (гентамицин, тобрамицин, амикацин, исепамицин, нетилмицин), выявленный у 7 (12,9%) штаммов, отсутствовал в СОКБ и ЦКБ и определен только у 1 (1,7%) изолята в КККБ (рис. 10).
Фенотип резистентности только к аминогликозидам III поколения А, И (амикацин, исепамицин) выявлен лишь в ГВКГ им. Н.Н. Бурденко у 6 (11,1%) изолятов.
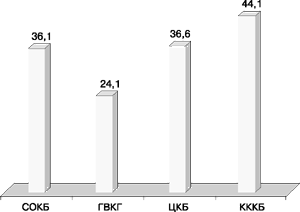
Рис. 7. Частота фенотипа резистентности гентамицин-тобрамицин-нетилмицин, %
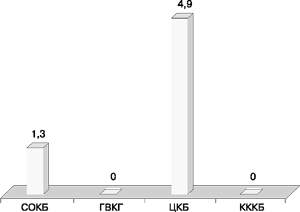
Рис. 8. Частота фенотипа резистентности гентамицин-тобрамицин-нетилмицин-амикацин, %
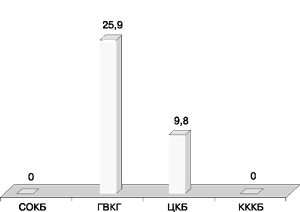
Рис. 9. Частота фенотипа резистентности гентамицин-тобрамицин-амикацин-исепамицин, %
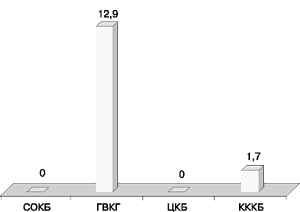
Рис. 10. Частота фенотипа резистентности гентамицин-тобрамицин-исепамицин-нетилмицин, %
Обсуждение результатов исследования
Эффективное использование антибактериальных препаратов невозможно без четкого представления об их фармакодинамических особенностях (механизмах действия антибиотиков и изменении их активности в зависимости от характера механизмов резистентности у микроорганизмов), а также без знания локальной ситуации антибиотикорезистентности в определенном регионе или (для госпитальных инфекций) в стационаре [31, 32].
Данное исследование показало, что во всех 4 центрах основными возбудителями госпитальных инфекций являлись одни и те же виды микроорганизмов: представители неферментирующих грамотрицательных бактерий, такие, как Acinetobacter spp. и P. aeruginosa, а также семейства Enterobacteriaceae, в основном E.coli, Enterobacter spp., K.pneumoniae, P. mirabilis. Преобладающим возбудителем в СОКБ и ГВКГ им. Н.Н. Бурденко была K.pneumoniae, в ЦКБ и КККБ – P. aeruginosa.
Исходя из полученных данных можно сделать вывод, что при выборе аминогликозидов для эмпирической терапии нозокомиальных инфекций в конкретных стационарах целесообразно основываться не только на общем уровне резистентности грамотрицательной микрофлоры, но и учитывать этиологическую роль того или иного патогена.
Так, гентамицин и тобрамицин не могут рассматриваться в качестве средств эмпирической терапии при любом грамотрицательном возбудителе нозокомиальных инфекций. О возможности использования нетилмицина можно говорить в том случае, когда инфекционный процесс вызван K.pneumoniae, P. aeruginosa или Acinetobacter spp. Однако при этом необходимо определять чувствительность этих штаммов к нетилмицину. Амикацин или исепамицин могут использоваться для эмпирической терапии, кроме случаев инфекции, вызванной Acinetobacter spp.
Необходимо отметить определенные отличия в фенотипах резистентности в центрах России. Поэтому при формировании подходов к оптимальному использованию аминогликозидных антибиотиков в первую очередь необходимо учитывать локальные данные о распространении и механизмах резистентности.
Проведенные исследования позволяют сформулировать две группы практических рекомендаций для врачей-микробиологов и клиницистов.
В о - п е р в ы х, следует рассмотреть подходы к оптимальному выбору аминогликозидов для лабораторного тестирования и к оценке получаемых данных. На основании нашего исследования оптимальным представляется рутинное определение чувствительности к гентамицину, нетилмицину и амикацину. С учетом результатов определения чувствительности к этим трем аминогликозидам и локальных данных о преобладающих фенотипах можно ориентировочно судить о генотипе и обосновать выбор терапии.
Однако выдавать ответ клиницистам следует избирательно. Так, например, при чувствительности к гентамицину достаточно информировать врача только об этом результате. В случае резистентности к гентамицину необходимо предоставить заключение о чувствительности ко всем трем аминогликозидам.
В о - в т о р ы х, непосредственно врачам-клиницистам целесообразно давать следующие рекомендации. В многопрофильном стационаре при эмпирической терапии необходимо учитывать резистентность нозокомиальных возбудителей к антибиотикам.
Разработать единую схему включения в эмпирическую терапию аминогликозидных антибиотиков для отдельного региона и даже стационара практически невозможно. И тем более нельзя копировать лекарственные формуляры, разработанные в других странах, и использовать в наших стационарах, так как уровень резистентности к аминогликозидам в России выше, чем в большинстве стран Европы и Америки. Задача каждого лечебно-профилактического учреждения – создать свой перечень эффективных препаратов.
Итак, для терапии грамотрицательных инфекций достаточно иметь в арсенале гентамицин, нетилмицин и амикацин. Амикацин можно использовать для эмпирической терапии, а также при резистентности к гентамицину во всех исследованных стационарах, кроме ГВКГ им. Н.Н. Бурденко. Нетилмицин и гентамицин следует использовать только при выделении чувствительной к ним грамотрицательной микрофлоры.
В ГВКГ им. Н.Н. Бурденко препараты группы аминогликозидов не следует использовать для эмпирической терапии нозокомиальных инфекций. Выбор препарата должен осуществляться только на основании данных антибиотикограмм.
Тобрамицин, а также новый аминогликозид исепамицин нецелесообразно включать в список необходимых антибиотиков в исследованных стационарах.
Полученные результаты, а также данные литературы [34] убедительно свидетельствуют о крайне широком распространении в стационарах лечебно-профилактических учреждений различных регионов России устойчивости к гентамицину (до 70% штаммов). Важно отметить, что, поскольку тобрамицин не обладает значительными преимуществами в сравнении с гентамицином, попытки его эмпирического включения в схемы лечения вместо гентамицина создают лишь иллюзию смены антибиотика и повышения эффективности лечения.
С нашей точки зрения, в исследованных стационарах следует исключить гентамицин из схем эмпирического лечения нозокомиальных инфекций. Необходимо привлечь внимание общественных и государственных организаций к крайне неблагоприятной ситуации с распространением устойчивости к аминогликозидным антибиотикам и разработать рекомендации по разумному ограничению клинического применения антибиотиков этой группы.
Благодарность. Выражаем искреннюю признательность за предоставленные штаммы микроорганизмов В.К. Тарабан (КККБ), Л.А. Ритчик (ЦКБ), С.В. Сидоренко (ГНЦА), а также С.В. Вакуленко (ГНЦА), G.H. Miller и F.J. Sabatelli (Schering-Plough Research Institute) за содействие в настоящем исследовании.